Fuel Cells
Introduzione
Alimentate ad idrogeno puro non producono emissioni inquinanti. In caso le celle siano alimentate a gas naturale le uniche emissioni sono dovute all’estrazione dell’idrogeno dal combustibile. Le emissioni foniche sono ridotte, permettendo l’installazione di questi impianti anche in zone abitate.
In un motore a scoppio, la combustione della benzina servirà per alimentare un ciclo espansione-compressione in un cilindro, e quindi per produrre lavoro e far muovere l'auto.
Il punto è che l'efficienza dei motori a scoppio è circa del 30%, ovvero solo il 30% dell'energia libera viene convertita in lavoro.
La tecnologia delle celle a combustibile ha cercato di superare questo problema pensando di fare avvenire la combustione del combustibile non a diretto contatto del comburente provocando una detonazione come nei normali motori, ma in maniera più controllata.
Le celle a combustibile sono dispositivi dove l'ossidazione del combustibile e la riduzione del comburente avvengono in due compartimenti separati. In ognuno di questi vi è un catalizzatore (platino), e i due catalizzatori sono collegati fra loro da un circuito in cui fluiscono gli elettroni trasferiti da combustibile a comburente mentre avviene la reazione. Questo flusso di elettroni è bilanciato da un flusso di cariche positive attraverso l'elettrolita che separa i due compartimenti. Gli elettroliti impiegati vanno da sali fusi a materiali polimerici, a materiali ceramici.
Anche se si tratta di reazioni catalizzate, il flusso di cariche sia nel circuito esterno che nell'elettrolita genera una parziale dispersione di energia, così come ne disperdono alcuni processi microscopici sul catalizzatore stesso. Pertanto, l'efficienza delle celle a combustibile si attesta su valori dal 40 al 50%, e che comunque sono sensibilmente più elevati che per i motori a scoppio.
Come funziona?
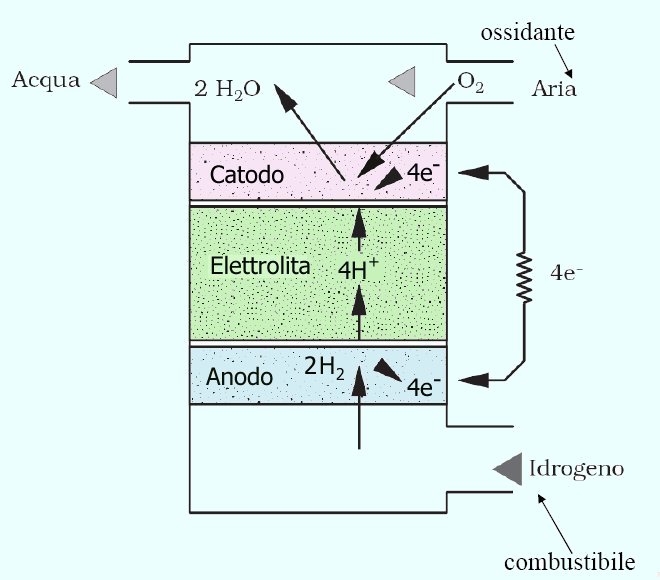
Il principio di funzionamento si basa sull’ossidazione (perdita di elettroni) dell’idrogeno all’anodo e la riduzione (acquisto di elettroni) al catodo, grazie alla temperatura della reazione, alla pressione dei gas ed alla presenza di metalli catalizzatori sulle superfici degli elettrodi.
Gli ioni H+ attraversano lo strato di elettrolita, gli elettroni attraversano un circuito esterno per ricombinarsi all’altro elettrodo, generando così un lavoro elettrico.
Il combustibile (idrogeno) viene immesso in uno dei due compartimenti della cella (dove avviene l'ossidazione o Anodo). A contatto col catalizzatore avviene la reazione:
2H2 -> 4H+ + 4e-
Gli elettroni (e-) scorrono attraverso il circuito esterno fino all'altro elettrodo. In questo compartimento (dove avviene la riduzione o Catodo) viene immesso ossigeno. L'ossigeno subisce il processo di riduzione:
O2 + 4e- -> 2O2-
Questo flusso di elettroni dall'anodo al catodo è la corrente che può essere prelevata dalla pila.
Appena prodotti, gli ioni O2- si legano con 2 ioni H+ che provengono dall'elettrolita acido e che possono attraversare l'elettrodo poroso. Si produce così acqua che viene rimossa come vapore dal semplice flusso di ossigeno. Gli ioni H+ ceduti dall'elettrolita vengono recuperati prelevando quelli che si erano formati all'anodo dall'H2.

la temperatura di esercizio deve rimanere piuttosto alta (circa 190 °C per le celle ad acido fosforico) per tre motivi principali:
- L'acqua prodotta deve poter essere rimossa, e questo richiede temperature non inferiori a 100 °C
- Il catalizzatore permette le due reazioni a temperature relativamente basse, ma la sua temperatura di esercizio è comunque piuttosto alta rispetto alla temperatura ambiente
-Per aumentare la conducibilità di soluzioni concentrate di acido fosforico servono temperature piuttosto elevate.
Il successo delle celle ad acido fosforico risiede nella bassa temperatura di esercizio se paragonate alle celle a carbonato fuso (650 °C) o ceramiche (1000 °C) e al relativo basso costo dei materiali.
Nello schema sottostante viene riportato il sistema di gestione di un impianto basato sulle celle a combustibile.
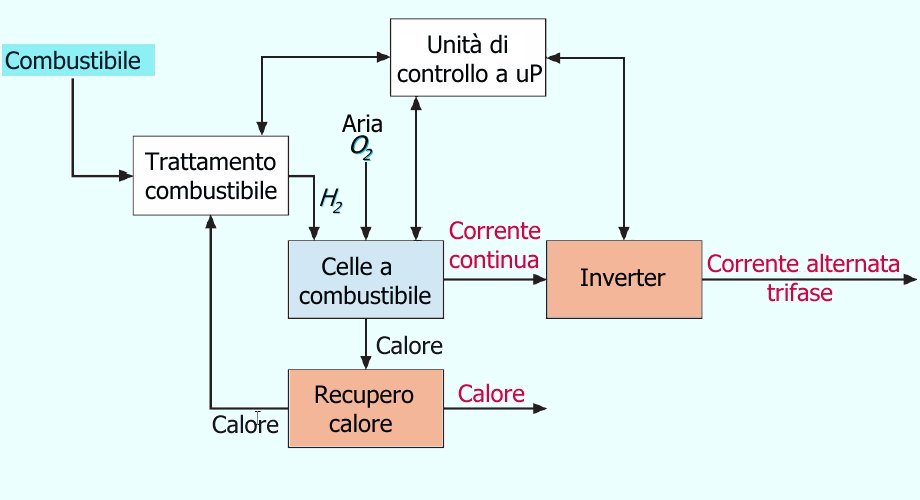
L'unita a microprocessore gestisce l'impianto e l'inverter genera una tensione alternata trifase o monofase con tensione stabilita dal costruttore.
Grazie all'inverter si possono ottenere tutti i valori di tensione che si vogliono, ma a parità di potenza piu' alta e' la tensione piu' bassa sarà la corrente fornita in uscita (infatti dalla relazione della potenza apparente si ha S (VA) = V*I ).
Ecco un elenco molto generico sulle varie tipologie delle celle a combustibile in commercio e in fase di valutazione.
|
Celle ad acido fosforico (PAFC)
Questo è il tipo maggiormente commercializzato. È già usata in diversi tipi d’applicazioni, come ospedali, case di riposo, alberghi, …, cogenerazione e impianti dimostrativi con potenze da 1÷11 MW. Il settore d’impiego più promettente è quello degli impianti di piccola taglia alimentati a gas naturale. |
|
Celle alcaline (AFC)
Sono state sviluppate soprattutto per usi speciali, la NASA le ha usate per le missioni spaziali. |
|
Celle a carbonati fusi (MCFC)
Operano a temperature di 600÷700° C. Attualmente allo stato di prototipi appaiono molto promettenti soprattutto per gli alti rendimenti previsti del 50-60% e per la possibilità di disporre di calore ad alta temperatura. |
|
Celle ad ossidi solidi (SOFC)
Usano dell’ossido di zirconio come elettrolita. Sono anch’esse allo stadio di prototipi e si prevede che potranno competere con quelle a carbonati fusi, il rendimento si aggira al 50÷75% e la temperatura di funzionamento è di 750÷1000°C. Le celle a combustibile ad ossidi solidi potranno nei prossimi anni essere una soluzione per la generazione di energia elettrica. |
|
Celle ad elettrolita polimerico (SPEFC)
Queste celle funzionano ad una temperatura relativamente bassa (70÷80°C) e hanno delle caratteristiche interessanti per la trazione elettrica, quali un’elevata densità di potenza, rapidità di partenza a freddo e di risposta alle variazioni di carico. |
|
Celle rigenerative (Regenerative fuel cells)
Vogliono essere degli alettanti generatori di potenza a ciclo chiuso. Una centrale solare, grazie all’effetto dell’elettrolisi, genera dall’acqua l’idrogeno e l’ossigeno necessari all’alimentazione della cella. |
|
Celle a metanolo diretto (DMFC)
Sono in grado di estrarre l’idrogeno necessario alla loro alimentazione direttamente dal metanolo senza la necessità di un reformer (trasforma il carburante in idrogeno). |
Conclusioni
Le limitazioni all'uso delle celle a combustibile rispetto a motori a scoppio sono l'alto costo dei materiali, la necessità di sistemi di sicurezza per lo stoccaggio dell'idrogeno o di altri combustibili, l'elevata temperatura di esercizio, la necessità di sistematica manutenzione e il peso.
Tuttavia il loro basso impatto ambientale le rende adatte per la produzione di energia ad esempio per uso civile in edifici.